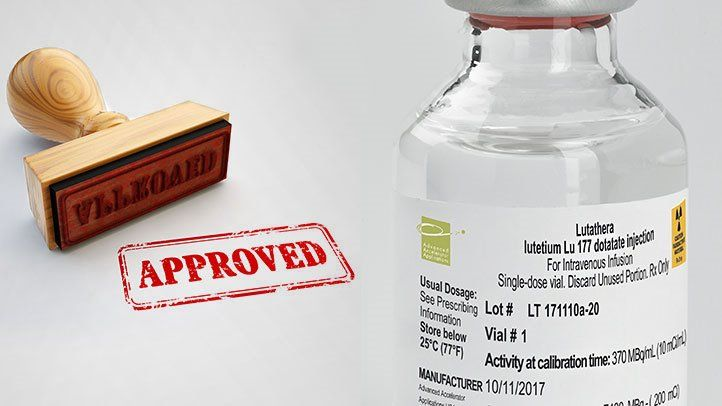
祝 6月23日 PRRT療法ルタテラが国内承認される
本日、富士フイルム富山化学株式会社は、放射性医薬品「ルタテラ®静注」(以下、「ルタテラ」)について、「ソマトスタチン受容体陽性の神経内分泌腫瘍」*1を適応症として製造販売承認を国内で取得したと報告しました。
「ルタテラ」は、ペプチド受容体放射性核種療法(Peptide Receptor Radionuclide Therapy; PRRT)に用いられる医薬品です。今回、「ルタテラ」は、「ペプチド受容体放射性核種療法剤」として国内で初めて承認されました。
この医薬品に関して、2010年ごろからスイスやドイツでPRRT療法による治療を受けたNET患者さんの体験談が契機となり、PRRT療法についての情報が拡散し始めました。しかし、同時に海外まで行かなければ受けられないという制限を解除してほしい、国内でもPRRTで治療を受けたいという多数の要望を受け、パンキャンジャパンでは署名を集めて「ルタテラの早期承認に関する要望書」を2015年5月に塩崎厚生労働大臣に提出させていただきました。それから6年、本当に長い期間でしたが関係者の皆様のご尽力のお陰でやっと実現できた承認です。関係者の皆様に心より感謝申し上げます。
神経内分泌腫瘍は、ホルモンやペプチドを分泌する神経内分泌細胞に由来する腫瘍で、全身のさまざまな臓器、なかでも膵臓、消化管および肺に多く発生します。選択できる薬物療法が限られていることから、アンメットメディカルニーズの高い疾患と言われています。現在、神経内分泌腫瘍に対してより有効な治療法が求められる中、神経内分泌腫瘍(NET)や前立腺がん患者が海外まで渡航しなければPRRT療法による治療が受けられないことが問題となっていました。
富士フイルム富山化学は、2015年に製薬大手ノバルティスのグループ会社であるAdvanced Accelerator Applications International S.A.(以下 AAA社)と、PRRTに用いる「Lutathera®」の国内開発・販売などに関するライセンス契約を締結し、その後、日本人患者での有効性および安全性を確認できたことから、2020年に製造販売承認申請を行い、今回の承認となりました。
■PRRT療法で使用するルタテラ静注(ルテチウムオキソドトレオチド):
ルタテラは、ソマトスタチン類似物質に放射性同位元素のルテチウム177を標識した治療用放射性医薬品で、「放射性リガンド療法」の一種であるペプチド受容体放射性核種療法(PRRT)に使用されます。PRRT療法とは、ペプチド受容体核医学内用療法(Peptide Receptor Radionuclide Therapy)の略です。放射性リガンド療法は、腫瘍に発現しているソマトスタチン受容体に特異的に結合する化合物に放射性物質を標識して患者に投与し、体内から病巣に放射線を照射する治療法です。PRRT療法は、腫瘍に発現しているソマトスタチン受容体を標的とするもので、事前に受容体が発現しているかオクトレオスキャンを使って調べる必要があります。
富士フイルム富山化学は、ルタテラを、ソマトスタチン受容体陽性の膵臓、消化管、肺の神経内分泌腫瘍の治療薬として承認申請しました。また、ライザケア輸液(L-リシン塩酸塩、L-アルギニン塩酸塩)は、「ルテチウムオキソドトレオチドによる腎被曝の低減」を対象疾患とする新医療用配合薬で、ライザケアはルタテラによる腎臓の被ばくを低減するために用いる輸液です。PRRT療法は、両剤を併用します。
https://www.fujifilm.com/fftc/
以上、










