海外ニュース: 祝 米国FDAは、オラパリブを、生殖細胞系BRCA変異陽性の転移性膵臓がんの一次治療維持療法として承認
2019年12月30日
オラパリブ(商品名:リムパルザ)は、プラチナベースの一次化学療法レジメンで少なくとも16週間で疾患が進行していなかった患者のがんの進行または死亡のリスクを47%削減しました。生殖細胞系BRCA変異陽性の転移性膵臓がんに唯一承認されたPARP阻害剤です。
米国ニュージャージー州ケニルワースのアストラゼネカおよびMSD Inc.(MSD:米国およびカナダではMerck&Co.、Inc.として知られています)は本日、成人患者の維持療法としてオラパリブが米国食品医薬品局(FDA)から承認を得たことを発表しました。
オラパリブ(商品名:リムパルザ)は、プラチナベースの一次化学療法レジメンで少なくとも16週間疾患が進行していなかった患者において、FDA承認されたコンパニオン診断で病的または病的であることが疑われる生殖細胞系BRCA変異陽性(gBRCAm)の転移性膵腺がん(膵がん)の患者が対象となります。
この適応症におけるオラパリブの承認は、The New England Journal of Medicineで発表され、2019年に米国臨床腫瘍学会年次総会(ASCO2019)にて発表された極めて重要な第III相POLO試験の結果に基づいて、12月17日の米国FDA腫瘍薬諮問委員会(ODAC)により推奨されました。
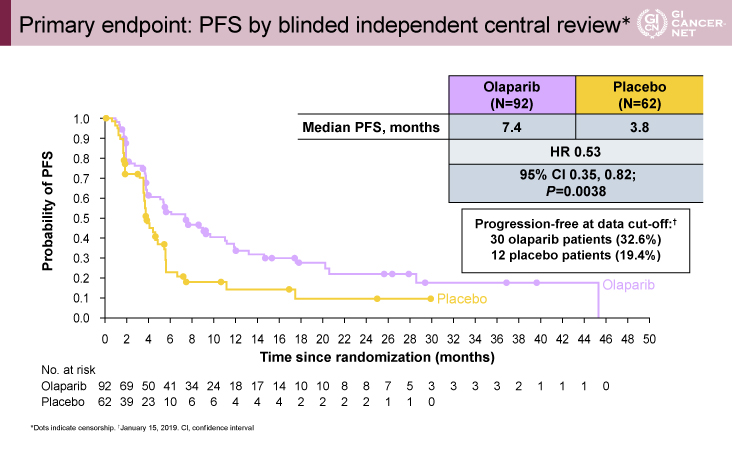
POLO試験の結果は、無増悪生存期間の統計的に有意で臨床的に意味のある改善を示しました。オラパリブは、gBRCAm変異陽性の転移性膵臓がん患者の進行や死亡なしの生存期間中央値を7.4か月対プラセボで3.8か月と、ほぼ倍増させました。(hazard ratio [HR] = 0.53; P = .0038). POLO試験でのオラパリブの安全性と忍容性のプロファイルは、以前の臨床試験で観察されたものと一致していました。
オラパリブは、DNA修復経路に異常をきたした腫瘍を利用し、優先的にがん細胞を死滅させるポリADPリボースポリメラーゼ(PARP)阻害剤です。本剤は、FDAにより承認されたコンパニオン診断検査であるBRACAnalysis CDx™により検出された、生殖細胞系BRCA遺伝子変異陽性(gBRCAm)の進行膵臓がんの治療薬として承認された最初のPARP阻害剤です。
■膵臓がんアクションネットワーク(米国パンキャン本部)
パンキャン本部の社長兼最高経営責任者であるジュリー・フレッシュマン氏は次のように述べています。「転移性膵臓がん患者は、壊滅的な疾患に対抗するための新しい治療選択肢を長い間待っていました。今日のオラパリブの承認は、生殖細胞系BRCA変異陽性、転移性膵臓がんの患者に刺激的な新しい治療選択肢を提供します。」 膵臓がんアクションネットワーク(パンキャン:PanCAN)は、膵臓がんの影響を受ける患者、介護者、およびコミュニティを代表してがん研究を支援し、がん研究を提唱する米国ロスアンゼルスに拠点を置く患者支援団体です。
■膵臓がんについて
膵臓がんは、アンメット・メディカル・ニーズが特に高い致命的ながんです。これは、世界で12番目に多く発生しているがんであり、がんによる死亡の主要な原因の7番目です。これは、一般的ながん種の中で最も低い生存率を示しています。ほぼすべての国で膵臓がんの5年生存率は一桁台2-9%に留まっています。
2018年には世界中で約460,000の新規症例がありました。初期段階では症状が非特異的であるため、ほとんどの場合、病気が転移した難治な段階で診断されます。その段階では、平均生存期間が1年未満となります。治療は、手術(患者の約10〜20%のみが対象)、化学療法、放射線療法であり、より効果的な治療選択肢に対するアンメット・メディカル・ニーズが特に高いのがこの疾患の特徴です。
■POLO試験について
POLO試験は、プラセボと比較したオラパリブ錠(1日2回300mg)の単剤療法を用いた、無作為化二重盲検プラセボ対照多施設共同試験の第III相試験です。この試験では、プラチナ製剤ベースの一次化学療法で疾患が進行しなかったgBRCAm転移性膵臓がん患者154人を対象として、ランダム化しました。患者は、ランダム化され(3:2)、疾患が進行するまでオラパリブまたはプラセボが投与されました。主要エンドポイントは無憎悪生存期間(PFS)であり、主要な副次エンドポイントには、全生存期間(OS)、二次疾患進行までの時間(TTP)、全体的な反応率(ORR)、健康関連の生活の質(QOL)が含まれていました。
結果は、無増悪生存期間の統計的に有意かつ臨床的に意味のある改善を示しました。オラパリブは、gBRCAm転移性膵臓がん患者の生存期間をプラセボの3.8か月に対して7.4か月とほぼ2倍に生存期間中央値(OS)を延長し、病気の進行または死亡のリスクを47%(HR 0.53 [95%CI、0.35-0.81]、p = 0.0035)も減少させました。 オラパリブによる維持療法の利点は、臨床的に意味のあるさまざまなエンドポイントで一貫して見られました。ベースラインで測定可能な疾患を有する患者では、23%がオラパリブに反応し、プラセボでは12%(オッズ比、2.30; 95%CI、0.89から6.76)、2年を超える治療期間の中央値(24.9ヶ月; 95 %CI、14.8から計算できなかった)vs 3.7ヶ月のプラセボ(95%CI、2.1から計算できなかった)。中間解析での二次エンドポイントである全生存期間(OS)は、オラパリブで18.9か月対プラセボで18.1か月でしたが、統計的有意差には達しませんでした(HR = 0.90; p = 0.68)。
POLO試験でのオラパリブの安全性と忍容性のプロファイルは、以前の臨床試験で観察されたものと一致していました。最も一般的な副作用(AR)≥10%は、疲労(60%)、悪心(45%)、腹痛(34%)、下痢(29%)、貧血(27%)、食欲減退(25%)、便秘(23%)、嘔吐(20%)、背痛(19%)、関節痛(15%)、発疹(15%)、血小板減少症(14%)、呼吸困難(13%)、鼻咽頭炎(12%)、好中球減少症(12%)、味覚障害(11%)、口内炎(10%)。グレード3以上の重篤な副作用は、貧血(11%)、疲労(5%)、好中球減少(4%)、食欲減退(3%)、血小板減少(3%)、腹痛(2%)、嘔吐(1%)および関節痛(1%)。 により、オラパリブの患者の23%で投与量が減量され、患者の6%では治療が中止されました。
POLO試験の結果に基づいて、2019年7月に膵臓がんのNCCNガイドライン(National Comprehensive Cancer Network:NCCN)が改訂され、gBRCAm膵臓がんの維持療法としてオラパリブが推奨されました。
米国では、FDA承認のコンパニオン診断BRACAnalysis CDx を用いてBRCA1またはBRCA2遺伝子変異の存在を検出します。遺伝子検査に基づいて、適格な転移性膵臓がん患者が選択され、治療を受けます。 BRACAnalysis CDxは、Myriad Genetics社が商品化し提供している検査方法です。
■オラパリブについて
オラパリブ(olaparib)はDNA修復経路に異常をきたした腫瘍を利用し、優先的にがん細胞を死滅させるポリADPリボースポリメラーゼ(PARP)阻害剤です。本剤は、FDAにより承認されたコンパニオン診断検査であるBRACAnalysis CDx™により検出された、生殖細胞系BRCA遺伝子変異陽性(gBRCAm)進行膵臓がんの治療薬として最初に承認されたPARP阻害剤です。現在、EUを含む65か国で承認されています