海外ニュース:膵がんサードライン治療薬、SM-88が進行膵がんに有望な結果を示す
著者 ジーナコロンバス
治験薬SM-88は、進行膵がん患者を対象とした第2相TYME-88-Panc試験で有望な生存期間を示しました1,2。
2019年の消化器がん世界会議(World Congress on Gastrointestinal Cancer)で発表された調査結果によると、RECISTの臨床的有用率(CBR)によって安定(SD)以上の良好な判定を受けた患者は、利用可能な画像の判定にて44%となり、少なくとも安定(SD)に到達した患者の死亡リスクは92%減少しました(HR 0.08; P = .02)。また、SM-88を投与された患者の大多数が7ヶ月以上、安定(SD)以上を維持したため、臨床的有用率(CBR)は耐久性があったと、治験薬の開発社であるTyme Technologies、Incはプレスリリースで報告しました。
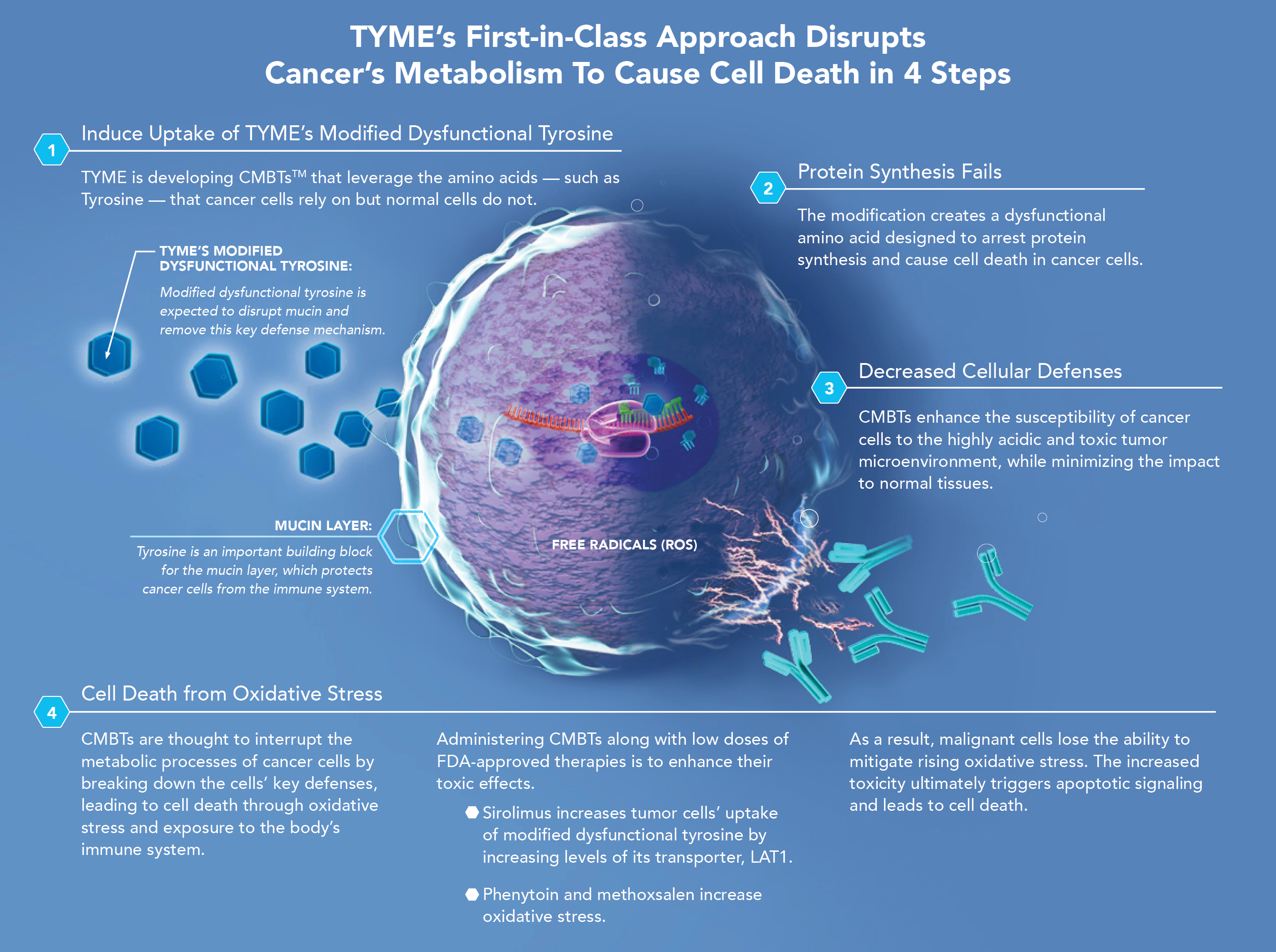
TYME社のSM-88は、がん代謝ベースの治療法(CMBTs™)という、新しいカテゴリーの治療薬です。がんの代謝の変化とそれに関連する脆弱性を活用して、基本的な細胞プロセスを特異的に破壊する独自の治験薬です。これには、タンパク質合成の変更、酸化ストレスの増加、pHレベルの低下、タンパク質または脂質バリアの低下が含まれます。さらに、CMBTは、オートファジーを含む選択された生存メカニズムを標的とするだけでなく、腫瘍の微小環境を変化させて癌細胞の免疫認識を改善する可能性があります。
「治療後期の膵臓がんでは良好な反応は非常にまれで、全体的な反応率はほぼゼロです。 SM-88試験は、有意義な臨床的有益率や循環腫瘍細胞の減少など、有効性指標に関する有望な新しいデータを実証しました。これらは両方とも生存期間の延長と相関しています」と、Weill Cornell Medicine並びにNewYork-Presbyterianの臨床医学准教授であるアリソン・オーシャン博士(Allyson Ocean、MD)は述べています。「これまでの研究結果は、SM-88が好ましい毒性プロファイルを持っていることも示しています。 1つの薬で両方の結果を得ることが非常に重要です。膵臓がんに対するサードラインの治療薬でFDA承認された治療法はなく、NCCNまたはASCOガイドラインの推奨事項もありません。これらの患者は、効果的な治療法を切実に必要としています。」
SM-88は、チロシン誘導体(D、L-α-メチロシン)、mTOR阻害剤(シロリムス)、CYP3a4誘導剤(フェニトイン)、および酸化ストレス触媒(メトックスサレン)からなる新しい経口抗がん剤治療です。関連するバイオマーカーはありません。
多施設非盲検2部第II相試験では、研究者らは、1つ以上の前治療を受け、ECOGパフォーマンスステータスが2以下で体調良好な、X線写真判定で進行性疾患の膵管腺がん患者を対象にSM-88を評価しました。患者は、1日460mgまたは1日920mgのSM-88を投与する群にランダム化され、すべての患者は、メトキサレンを1日10mg、フェニトインを1日50mg、シロリムスを1日0.5mg投与されました。
研究のパート1は、最適な投与量と、SM-88の追加開発をサポートするために必要とされる初期の臨床的利益を判断するために設計されました。 2019年の消化器がんシンポジウムで発表されたデータでは、試験結果は、28人の評価可能な患者の67.8%が2018年12月31日時点で生存していたことを示しました。ここでは治療開始後の追跡期間の中央値は4.3ヶ月でした。
2019年の消化器がん世界会議で発表された最新のデータには、転移性膵がんを患う49人の高度に前治療された患者が含まれ、これらの患者も重大な疾患関連の罹患率を示しました。ベースライン特性は、ITT集団(Intention-To-Treat)(n = 49)と有効性評価可能なグループ(n = 38)の間で類似していました。年齢の中央値は66.5歳で、患者の大多数(> 80%)は2つ以上の前治療を受けていました。
全生存期間(OS)の中央値6.4か月は、38人の有効性評価可能な患者に対するものでした。 ITT集団の49人の患者の中での結果は、予備的なカプランマイヤー由来の全生存期間(OS)中央値が3.6ヶ月であることを示しました。
「これらの成果は、SM-88の開発を進めることをさらに正当化するものと信じています。これらの生存率の結果は、報告された過去の19の前向き試験によるサードライン治療後の生存期間中央値が2.0〜2.5か月であったことと比較して非常に有利です」とジュゼッペ・デル・プリオーレ医学博士、MPH、タイム社最高医療責任者はプレスリリースで述べました。 「この患者集団を治療するための効果的な選択肢が現在ないことを考えると、膵がんを対象としたSM-88ピボタル試験を進める予定です。 SM-88が後期膵がん患者の新しい治療アプローチになる可能性があることから、ますます勧められていると感じています。」
試験の研究者は、学会中に提示されたサブグループ解析も実行しました。急速に低下する予後因子に関連するいくつかのスクリーニング基準には、2系統以上の前治療を受け、75歳以上であり、アルブミンが3.5g / dl未満である状態の悪い患者も含まれていました。同社は、これらの予後不良の特徴を持たない患者は、より良い生存傾向を示したと述べました(HR、0.36; 95%CI、0.1-1.3; P = .12)。
さらに、SM-88で生存アウトカムが改善した主要なサブグループは、女性(HR、0.21; 95%CI、0.06-0.73; P = .01)と、1つまたは2つの前治療を受けた患者でした。3つを超える前治療を受けた患者は比較して生存アウトカムが改善しませんでした(HR、0.56; 95%CI、0.21-1.5; P = .26)。ベースラインの血中循環腫瘍細胞(CTC)が50細胞/ 4 mL以下の患者も、全生存期間(OS)が改善する傾向を示しました(HR、0.26; 95%CI、0.06-1.2; P = .08)。
血中循環腫瘍細胞(CTC)と生存率との関連を示すために、追加の分析が行われました。 血中循環腫瘍細胞(CTC)の減少の中央値は63%であり、血中循環腫瘍細胞(CTC)が減少した患者の56.3%は、血中循環腫瘍細胞(CTC)が増加した患者の37.5%と比較して、全生存期間(OS)が180日を超えていました。 血中循環腫瘍細胞(CTC)が80%以上に低下した患者(n = 24)は全生存期間(OS)が改善する傾向があり(HR、0.4; 95%CI、0.11-1.5; P = 1.8)、最下点で50細胞/ 4mL以下の患者も良好な全生存期間(OS)を示しました(HR、0.64; 95%CI、0.2-2.1; P = .45)。 261 日、262 日、および343日と最も長い生存期間を示した患者グループでは、80%を超える血中循環腫瘍細胞(CTC)の減少と50細胞/ 4mL未満の両方が見られました。
安全性に関しては、治療に関連する可能性のある重篤な有害事象(SAE)がITT人口の4%で報告されており、腹痛、関節痛、低血圧が含まれていました。 SAEを経験した1人の患者は治療を続けました。 ITT集団では、患者の94%が全グレードのAEを経験し、その17%が治療に関連している可能性があり、12%がグレード3/4でした。
2019年7月9日、タイム社とマニュアル・イダルゴ博士(Manuel Hidalgo、MD)が行った電話会議では、SM-88に関する最新のデータに関するイダルゴ博士の見解が紹介されました。
「まず、SM-88には新しい作用メカニズムがあります。それはがん細胞の新陳代謝を攻撃する薬です。これは、このクラスの新しい化合物の最初の薬剤の1つであり、がん治療の新しい波です。この研究は、いくつかの非常に興味深いことを示しています。一方では、薬は経口剤であり、それは常に利点です。第二に、それは非常に忍容性が高く、非常に安全であり、脆弱な患者集団において最も重要です」と、Weill CornellMedicineおよびNewYork-Presbyterianの血液学および腫瘍内科の責任者であるイダルゴ博士は説明しました。 「標準治療が2〜3か月の生存期間の集団には、6.4か月の生存期間は非常に有望です。」
イダルゴ博士はまた、電話会議における血中循環腫瘍細胞(CTC)の減少と有利な全生存期間(OS)との関連についての洞察を提供しました。
「これらは非常に重要なデータです。将来の研究でこの薬の恩恵を受ける可能性のある潜在的な集団を助けることになるからです」と彼は付け加えました。 「私たちは、進行性難治性膵がん患者を治療するために、この薬剤をポートフォリオに含めることを本当に楽しみにしています。」
FDAとの話し合いに続いて、SM-88は第II / III相臨床試験(NCT03512756)で検証されます。この試験では、疾患が進行または再発した膵臓の転移性腺癌患者がランダム化されてSM-88を投与されます(n = 〜100)。または患者は、治験責任医師の選択した治療法(n = 〜100)による2つの前治療ラインを受けている必要があります。主要エンドポイントはOSです。副次的評価項目には、CBR、CTC、および生活の質(QOL)が含まれます。
さらに、SM-88は、膵がん患者の複数の治療レジメンを試験している米国パンキャン本部(正式名称:膵臓がんアクションネットワーク)のプレシジョンプロミス(PrecisionPromise)臨床試験プラットフォームでも調査されます。
「これらの更新されたデータに非常に勇気づけられています。 タイム社の最高執行責任者であるミシェル・コーフィン薬学博士(MicheleKorfin、RPh、MBA)は、電話会議で次のように述べています。 「残念ながら、膵がん患者さんは予後が非常に悪く、追加の治療オプションがどうしても必要です。 タイム社は、膵がん患者のためのより良い、より安全な治療オプションを提供するために、患者、医師、膵臓がんアクションネットワーク(米国パンキャン本部)を含む患者団体との重要なパートナーシップを楽しみにしています。」
編集注:米国パンキャン本部が昨年スタートした『Precision Promise』という高効率のアダプティブデザインによる臨床試験では、試験薬に今回、発表されたSM-88が使われています。日本でもこの試験薬を使用した治験に膵がん患者が参加できることが強く望まれています。
References:
TYME Presents Updated Data at ESMO GI 2019 from TYME-88-Panc Phase II Study Demonstrating Encouraging Overall Survival Trends in Patients with Advanced Pancreatic Cancer. Tyme Technologies, Inc. Published July 5, 2019. https://bit.ly/2xNYEjr. Accessed July 9, 2019.
Noel MS, Wang-Gillam A, Ocean AJ, et al. SM-88 therapy in high-risk poor prognosis pancreatic cancer (PDAC). Ann Oncol. 2019;30 (suppl_4). doi: 10.1093/annonc/mdz155.058.
Noel MS, Wang-Gillam A, Ocean AJ, et al. Phase II trial of SM-88 in patients with metastatic pancreatic cancer: Preliminary results of the first stage. Presented at: 2019 Gastrointestinal Cancers Symposium; January 17-19; San Francisco, CA. Abstract 200.
TYME ESMO GI Conference Call. Tyme. Published July 9, 2019. https://bit.ly/2YIEbbx. Accessed July 9, 2019.
編集注:臨床的有用率(CBR)とは、どれくらいの割合で効果が得られたかの割合を表したもので腫瘍縮小効果のうち、治療開始から増悪、再発までに記録された最良の効果を示す最良総合効果(Best overall response)。CBRは、完全奏効(Complete Response:CR)、部分奏効(Partial Response:PR)、又は24週以上継続した症状安定(Stable disease:SD)と規定されています。CR + PR + SD(24 週)(参照:オンコロ)
編集注:ECOGパフォーマンスステータス(JCOGサイトより引用)
|
core |
定義 |
|
0 |
全く問題なく活動できる。発病前と同じ日常生活が制限なく行える。 |
|
1 |
肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる。例:軽い家事、事務作業 |
|
2 |
歩行可能で自分の身の回りのことはすべて可能だが作業はできない。日中の50%以上はベッド外で過ごす。 |
|
3 |
限られた自分の身の回りのことしかできない。日中の50%以上をベッドか椅子で過ごす。 |
|
4 |
全く動けない。自分の身の回りのことは全くできない。完全にベッドか椅子で過ごす。 |