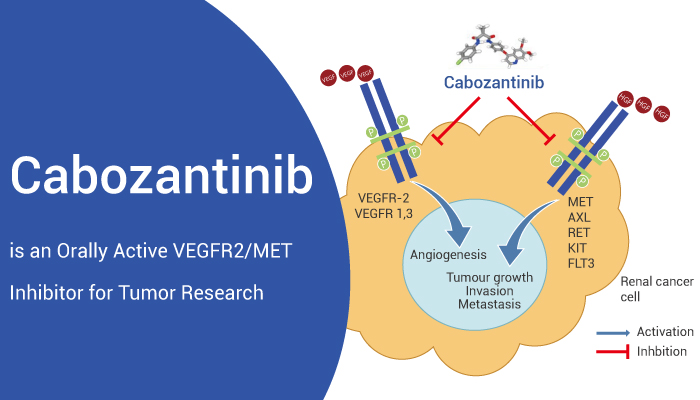
Ref: 「Cabozantinib is an Orally Active VEGFR2/MET Inhibitor for Tumor Research」Edward Jenner 2023-08-28 IMMUNE SYSTEM RESEARCH
(祝)FDA、pNETおよびepNETに対するカボザンチニブを承認
2025年3月26日、米国食品医薬品局(FDA)は、以前に治療を受けた切除不能な局所進行または転移性の「良く分化した」膵神経内分泌腫瘍(pNET)および膵外神経内分泌腫瘍(epNET)を有する12歳以上の成人および小児患者に対して、カボザンチニブ(製品名:Cabometyx、製造元:Exelixis社)を承認しました。
カボザンチニブの処方情報は後日こちらに掲載される予定です。
治験データ(CABINET試験)について
カボザンチニブの有効性は、CABINET試験(NCT03375320)で評価されました。これは、二重盲検・プラセボ対照の多施設共同試験で、pNETおよびepNETの2つの無作為化コホート(合計298人)に分かれて実施されました。いずれのコホートも、以前の治療で進行した切除不能な局所進行または転移性のNET患者が対象です。
主要評価項目は**無増悪生存期間(PFS)**で、RECIST 1.1基準に基づき独立した放射線画像判定委員会(BIRC)が評価しました。副次的な評価項目には、**奏効率(ORR)および全生存期間(OS)**が含まれました。
🔹 pNETコホート(99人)
-
カボザンチニブ 60mgを1日1回内服、またはプラセボを投与(2:1の割合で無作為化)
-
PFS中央値:カボザンチニブ群 13.8ヶ月(95% CI: 8.9–17.0)/プラセボ群 3.3ヶ月(95% CI: 2.8–5.7)
-
ハザード比(HR):0.22(95% CI: 0.12–0.41)/p値 < 0.0001
-
奏効率(ORR):カボザンチニブ群 18%(95% CI: 10–30)/プラセボ群 0%(95% CI: 0–11)
-
OSデータは未成熟(カボザンチニブ群の48%、プラセボ群の52%が死亡)
-
**52%**のプラセボ群がカボザンチニブ群へクロスオーバー
🔹 epNETコホート(199人)
-
同様の治療レジメンで2:1に無作為化
-
PFS中央値:カボザンチニブ群 8.5ヶ月(95% CI: 6.8–12.5)/プラセボ群 4.2ヶ月(95% CI: 3.0–5.7)
-
HR:0.40(95% CI: 0.26–0.61)/p値 < 0.0001
-
ORR:カボザンチニブ群 5%(95% CI: 2.2–11)/プラセボ群 0%(95% CI: 0–5)
-
OSデータは未成熟(カボザンチニブ群の63%、プラセボ群の60%が死亡)
-
**37%**のプラセボ群がカボザンチニブへクロスオーバー
用量と安全性
-
体重40kg以上の成人および12歳以上の小児:60mgを1日1回内服
-
体重40kg未満の12歳以上の小児:40mgを1日1回内服
-
安全性プロファイルは、すでに承認されているものと一致しています
国際連携と規制プロセス
この承認は、FDA腫瘍卓越センターの「Project Orbis」のもとで行われました。このプロジェクトは、がん治療薬の国際的な同時申請および審査の枠組みで、今回はオーストラリアのTGAおよびスイスのSwissmedicと連携しています。その他の機関での審査は継続中です。
また、ローリングレビューと申請者による「Assessment Aid」を活用し、審査が効率化されました。
医療関係者への情報
副作用に関する深刻な報告は、FDAのMedWatch報告システム(1-800-FDA-1088)へ連絡してください。
また、治験薬の個別患者用INDに関する支援は、FDA「Project Facilitate」まで(電話:240-402-0004、メール:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。)お問い合わせください。
このような最新のがん治療の情報にご関心がある方は、Chatgpti.co/ja をチェックしてみてください。












