2021年度版要望書
更新日:2021年3月27日

膵臓がん患者の現状
日本のがん患者は欧米で開発・承認された抗がん剤を使用しています。問題は米国食品医薬品局(FDA)が承認した薬剤が日本で承認され、患者がその新薬により治療を受けることができるまでには未だに大きな時間差(ドラッグアクセス・ラグ)があるのが実情です。この状況は、ゲノム医療がスタートしたことにより、深刻化してきています。
米国FDAは2015年10月にはドラッグデリバリーシステム(DDS)改良型のイリノテカンリポゾーム注射剤(商品名オニバイド)、2017年5月には、膵臓がんではじめてチェックポイント阻害剤ペンブロリズマブ(商品名:キイトルーダ)、2018年12月にはNTRK融合遺伝子変異陽性に対するエヌトレクチニブ(商品名ロズリートレク)、2019年12月にはBRCA1/2遺伝子変異陽性の患者に投与されるオラパリブ(商品名リムパーザ)を承認しました。これらの薬剤は、2020年末から2021年に入り、次々と日本でもPMDAによって承認されてきました。しかし、患者が最新のゲノム医療にアクセスできるのかと言えば、承認後でもアクセスできないという問題が患者を悩ましています。
このドラッグラグ、アクセスラグには、大きくわけて2つの問題があります。まず、ゲノム医療の入口である、がん遺伝子パネル検査の使用についてと、出口、ようするに、パネル検査の結果判明した遺伝子変異に対応する薬剤の使用についてです。
ゲノム医療の第一歩であるがん遺伝子パネル検査が2019年に保険償還され、ゲノム医療がスタートしました。しかし、日本の膵癌診療ガイドラインと同じ米国のNCCNガイドラインでは、膵癌診断時に生殖細胞系遺伝子検査を全員に受けることが推奨されており、また、転移性膵癌患者には同時にがん遺伝子パネル検査を推奨しています。米国の場合、早い段階でファウンデーションワンCDX(FoundationOneCDx)とMSK-IMPACTの2種類が承認されていましたが、それプラス、ファウンデーションワンリキッドという組織生検の必要がなく、血液検査で診断できる遺伝子検査も承認されています。日本でも2019年に2つのがん遺伝子パネル検査が保険償還され、2021年3月にファウンデーションワンリキッドも承認されました。検査の選択肢は日本でも米国同様に増えてきてはいますが、肝心のがん遺伝子パネル検査を診断時に受けることができず、標準療法を受けた後にしか検査を受けることができないために、治療の機会を失う難治性がん患者が日本では続出しています。
米国のパンキャン本部が行ったKnowYourTumor(ノー ヨア チューマー)研究では、25.4%の膵臓がん患者にアクショナブルな遺伝子変異が見つかり、その後、マッチした治療薬を投与された場合、マッチした治療薬を投与されなかった患者群、標準治療の患者群に比較して、治療成績が良かったことから、2019年にNCCNガイドラインが改訂され、遺伝子検査が診断時に推奨されるようになりました。ゲノム医療の入口に関する問題については、日本の膵癌診療ガイドラインは2022年に日本膵臓学会により改訂になりますので、その時に診断時にがん遺伝子パネル検査が推奨されることがとても大切です。
続いて出口の問題ですが、ゲノム医療の選択肢として大きな役割を担うのが、遺伝子変異(腫瘍マーカー)にマッチした分子標的薬を使った臨床試験です。いま米国では膵臓がんの領域で140以上の臨床試験が実施されております。そのなかには、2年という短期間でFDA承認まで到達する新しいタイプの臨床試験も含まれています。しかし、ゲノム医療の希望と言われている臨床試験・治験が日本では少ないことが、患者の不利益につながっています。また、日本では米国のように適応外薬(オフラベル)が使用できません。そのように、がん遺伝子パネル検査後の治療選択肢(臨床試験、遺伝子変異にマッチした適応外薬の使用)が極端に限定されているため、パネル検査を勧めない医療者もいるくらいです。そのような問題を解決しようと患者申出療養制度を使って、臓器横断型受け皿試験をゲノム医療の中核病院では進めています。現在、製薬企業3社から10種類以上の薬剤が無償提供されていますが、この制度下では、使われた薬剤の治療成績により即承認、適応には至らないことが課題です。また、全国12か所の中核拠点病院に行かないとそもそも患者申出療養制度を受けるができないこともあまり知られていないという問題があります。
短期間に患者に新薬を届けることができる臨床試験と承認体制こそ、いまゲノム医療がスタートして、拡大しつつある適応外薬及び臨床試験欠如の問題で苦しむ日本の膵臓がん患者が必要としている体制です。ぜひそのような新しい体制を一日でも早く日本で実現し、ドラッグラグ、アクセスラグ・ゼロを実現したいとパンキャンジャパンは考えています。
日本のがん患者は欧米で開発・承認された抗がん剤を使用しています。問題は欧米で開発・承認された抗がん剤が日本で承認あるいは適応拡大されるまでには、未だに大きな時間差(ドラッグ・ラグ)があるのが実情です。膵臓がん患者がドラッグ・ラグ解消を求め、署名活動を行い、厚生労働省に提出し勝ち取ったのがゲムシタビンの承認でした。それから 10 年たち、膵臓がん患者により、再度署名活動が行われ、承認されたのがエルロチニブでした。しかし、承認されるまでがゲムシタビンで 5.1 年、エルロチニブで 5.7 年もかかりました。
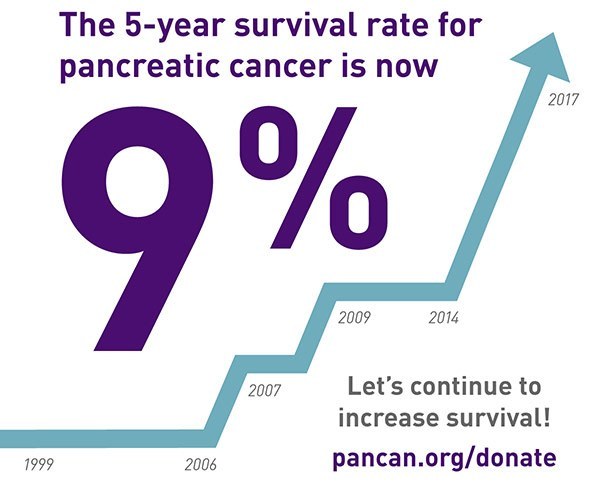
パンキャンジャパンが活動をはじめたころは、他のがんでは 15 剤くらいの抗がん剤が使えましたが、膵臓がんでは使える抗がん剤が少なく、ゲムシタビンしかありませんでした。その後、S-1、エルロチニブ、フォルフィリノックス、ナブパクリタキセルが承認されました。2015年10月にFDA承認されたゲムシタビンに耐性ができた患者向けイリノテカンリポゾーム注射剤(商品名オニバイド)も2020年には日本で承認されました。これらの抗がん剤は、症状緩和、延命効果などの効果が認められていますが、治療を続けていくうちに耐性ができて効果がなくなるケースが多く見られます。欧米で標準的に使われる抗がん剤にはゲムシタビン、エルロチニブ、フォルフィリノックス、腹膜播種などの治療で使われるドセテキセル、カペシタビン、ゲムシタビンとの併用で使われているナブパクリタキセルのほか、2017年5月にFDA承認されたMMR遺伝子欠損陽性患者向け免疫療法である抗PD-1抗体薬ペンブロリズマブ(商品名:キイトルーダ)、家族性膵臓がん患者に有効と言われているプラチナ系製剤であるシスプラチンなどがあります。さらに、分子標的薬では、2018年11月に承認となったNTRK融合遺伝子変異に対するラロトレクチニブ(商品名ビトラクビ )、2019年12月に承認となったBRCA遺伝子変異陽性に対するオラパリブ(商品名リムパーザ)などがありますが、すべて日本でも2021年3月までに承認されました。また、日本では世界に先駆けてNTRK1/2・ROS1融合遺伝子変異に有効なエントレクチニブ(商品名ロズリートレク)が2019年に膵臓がんでも承認となっています。米国同様、FDA承認された新薬は次々と日本で承認されてきていますが、問題は、それらの新薬を使ったゲノム医療を日本の膵癌患者は受けることができない、ようするに『ドラッグアクセスラグ問題』があることです。5年生存率が70%以上という他の癌種と異なり、過去40年間5年生存率が唯一一桁台という、難治性癌のなかで最も治療が困難な、特殊な癌が膵臓がんですが、その病気に適したゲノム治療が受けられない状況が続いています。
国内でも他のがんの治療にすでに使用されている最新のゲノム医療に関連したバイオマーカーに基づいた分子標的薬、免疫療法などは、米国で膵臓がんの治療に使われていて、国内でも他のがんの治療に使われているにもかかわらず、国内で膵臓がんには適応になっていないため、いまだに使うことができません。これからは遺伝子検査により効果が期待される適応外薬の医薬品が膵臓がんでもますます重要となってくることが予測されます。しかし、承認体制の整備が遅れているため、米国NCCNガイドラインに推奨されているように、転移性膵臓がん患者は診断時にがん遺伝子パネル検査を受けられるように配慮し、遺伝子変異にマッチした適応薬・適応外薬が投与されるよう、体制の整備を進めることをお願いします。進行している膵臓がん患者がこれ以上苦しみ続けることのないよう、このドラッグラグ問題(適応外薬問題)の早急な解決を強く要望いたします。
特定非営利活動法人パンキャンジャパン
理事長 眞島喜幸
要望の趣旨
ドラッグアクセス・ラグを解消し、米国と同様なゲノム医療が受けられるよう、また、欧米の標準治療薬の1日でも早い承認をお願いします。
署名のお願い
ご家族、親族、会社同僚、友人など、広く署名活動への協力を呼び掛けてくださいますよう、お願い致します。署名方法は、インターネット、または 手書きのどちらでも結構です。
■方法1:インターネットで署名する場合(2021年度版)
各署名リストは最大500名様までご登録できます。署名リストが500名に達しましたら、それ以上、お名前は書き込むことができませんので、次のリスト、署名リスト2にご記入ください。
→ネット署名はこちらから(お一人ずつ氏名、住所を入力するだけで結構です。)署名リスト2
■方法2:手書きで署名する場合
※署名用紙の締切日には関係なく、届いた署名はすべて集計し、提出のために綴らさせていただいております。
|
ボタンをクリックすると、Webの署名フォームに 移動します |
署名用紙をダウンロードの上、お使いください。 送付が必要です 〔送料等はご負担ください〕 |
<記入方法の留意点>
住所は都道府県から番地までお1人ずつ記入して下さい。
“同上” ならびに “〃” という表記を使用しないでください。
使用されますと、その署名が無効になる場合がございます。
ご家族にかわって代筆されても結構です。ボールペン、サインペンなどで署名して下さい。
署名する人には年齢制限はありませんが、日本在住の方に限ります。
<署名者のプライバシー保護>
ご記入いただきました情報は、厚生労働省へドラッグラグ解消に関する要望書提出の際に
一緒に提出させていただきます。オンライン署名は、印刷の上、他の署名用紙と一緒にバインドし、
提出させていただきます。それ以外で使用されることはありませんのでご安心ください。
<署名用紙の送付先>
郵送: 〒102-0071 東京都千代田区富士見1-12-1 QDANビル5階
NPO法人パンキャンジャパン
恐れ入りますが、署名用紙の送料はご負担お願いいたします。
FAX: 03-3221-1422
メール: 署名済用紙をPDF化しメール添付の上送付ください。
EMAIL先は このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。
署名に関するお問い合わせ
NPO法人パンキャンジャパン 事務局
電話:03-3221-1421 E-mail:このメールアドレスはスパムボットから保護されています。閲覧するにはJavaScriptを有効にする必要があります。