すい臓がんの治療には、多くの抗がん剤が必要です。それは、抗がん剤の効果は平均的には認められていますが、個人差があります。奏効率(=投薬によってがんに変化がみられる率)は1-3割の抗がん剤が多く、治療に当たっては抗がん剤の選択肢が多いことが患者の希望につながります。
抗がん剤の新薬は臨床試験(第三相試験)で標準治療薬との比較試験で優れた成績がえられれば認可するの通常の手続です。日本国外で開発されている抗がん剤の場合、開発国で認可されれば、そのまま日本国内でも承認されるわけではありません。再度日本国内で臨床試験をして承認を得る必要があります。自由診療として日本国内でも未承認薬を使うこともできますが、保険適用外のため極めて高額な費用がかかります。

海外ではすでに標準治療薬として使用されているのに日本国内では使えない、この問題をドラッグラグといいます。5年生存率が約90%の乳がんでは抗がん剤が20種類以上ありますが、すい臓がんでは4種類(国内。2014年1月時点)しかありません。パンキャンジャパンはすい臓がん患者の希望をつくるためには、このドラッグラグを解消し、抗がん剤の選択肢をさらに増やさなければならないと考えています。

今回承認されたナブパクリタキセル(英語表記:Nab-Paclitaxel/商品名:アブラキサン)は、切除不能なすい臓がん向けに治療に効果が認められた抗がん剤です。2013年9月に米国FDA(アメリカ食品医薬品局)ですい臓がんの承認をうけました。日本では大鵬薬品が米国セルジーン社からライセンスを得ています。すでに日本国内で2010年に乳がんで承認を受けて使用されていましたが、すい臓がんは承認を受けてけていない、ドラッグラグの状態にある抗がん剤でした。
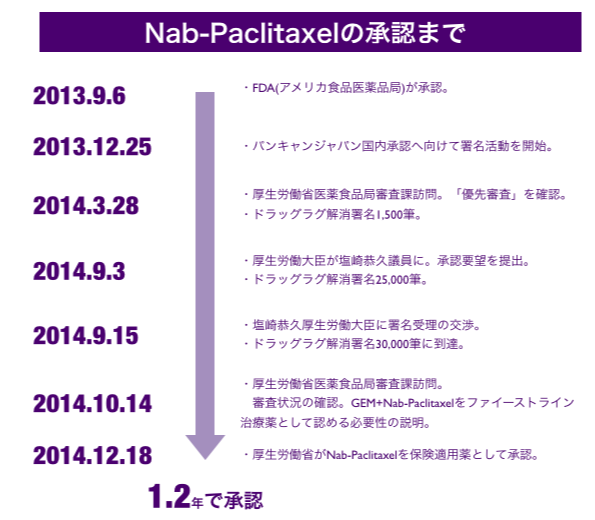
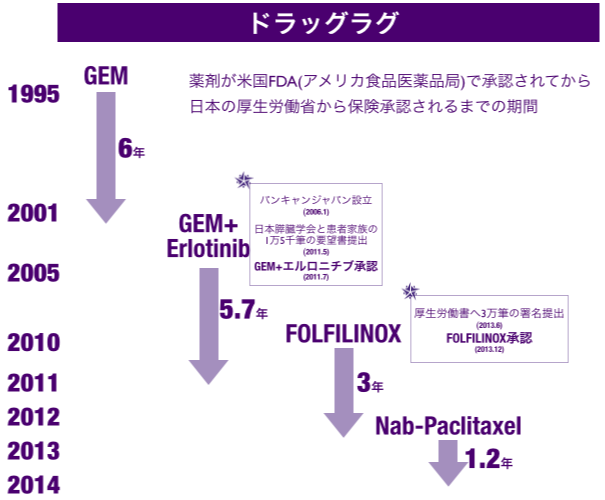 パンキャンジャパンは、2006年の設立以来ドラッグラグ問題解消の為に活動を続けてきました。今回のナブパクリタキセルについては、最短の1.2年(15ヶ月)で国内承認を実現することができました。
パンキャンジャパンは、2006年の設立以来ドラッグラグ問題解消の為に活動を続けてきました。今回のナブパクリタキセルについては、最短の1.2年(15ヶ月)で国内承認を実現することができました。

ドラッグラグ問題を根本的に解決するためには、新薬の国際共同治験に参加することが必要です。国際共同治験とは、米国企業が開発する場合には、日本も同時に臨床試験に参加することです。そうすれば、米国と日本の同時承認が可能になります。
実は、パンキャンジャパンは2011年6月に米国セルジーン社(Abraxaneの開発元)に、第三相国際共同治験に日本も参加できないかを直接交渉をしましたが認めて貰えませんでした。これを解決するには、日本国内でも臨床試験を円滑かつ迅速に実施できる環境を整えていくことが必要だと言われています。そうしない限り、国際共同治験において日本は後回し(ジャパンパッシング)になり続けます。
参照:国内ニュース:<ドラッグ・ラグ問題>日本経済新聞の「医出づる国」(8月25日)特集
日本のすい臓がんの研究発展のためには、公的・私的助成金をつかい、臨床試験を含めた日本のすい臓がん研究環境を支援することが不可欠です。
パンキャンジャパンでは「膵がん撲滅基金」を通して寄付を集めています。日本の膵癌研究発展のために是非ともご協力ください。










