海外ニュース:FDAは膵がん新薬エリスパーゼに優先審査を付与
2020年4月28日
ERYTECH Pharma社は、米国食品医薬品局(FDA)がエリスパーゼにFast Track Designationを付与したと本日発表しました。ERYTECH社は、赤血球内に治療薬をカプセル化する革新的な治療法を開発するバイオ製薬会社で、エリスパーゼは、転移性膵臓がん患者のセカンドライン治療薬として開発されています。
編集注:ファーストトラックプログラムとは、米国食品医薬品局(FDA)による、完治が難しい疾患に対し、高い治療効果が期待できそうな新薬を優先的に審査する制度。指定を受けると、新薬承認申請(NDA)の提出前や申請途中にもFDAとの協議が促進され、臨床試験デザインやデータ提出に関する問題を回避しやすくなっています。
エリスパーゼは、欧米の11か国で転移性膵臓がんの第3相試験(TRYbeCA-1)で現在評価されています。試験に登録される約500人の患者の75%以上が無作為化されました。イベントの3分の2が発生したときに独立データ監視委員会(IDMC)が実施する暫定的な優位性分析は、2020年末頃に行われ、最終分析は2021年後半に行われる予定です。
■膵臓がんのセカンドライン治療薬エリスパーゼ
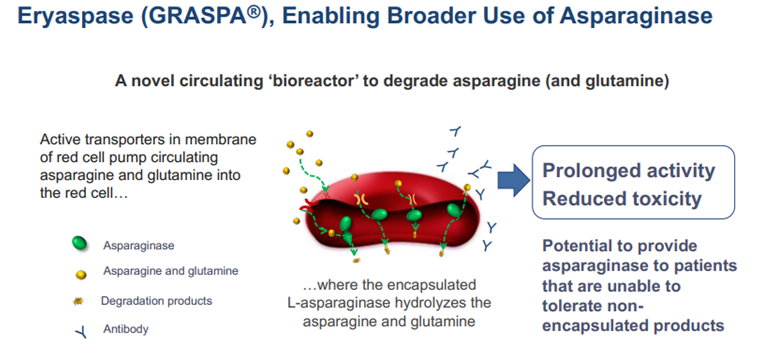
エリスパーゼは、がん細胞の変化したアミノ酸代謝を標的にすることを目的として、ドナー由来の赤血球の中にカプセル化されたL-アスパラギネーゼを組み込んだ新しい治療法です。
がん細胞は、異常な成長と急速な分裂を維持するために、栄養素の継続的な供給を必要とします。グルコースだけでなく、アミノ酸もがん細胞の高い代謝をサポートするために不可欠です。
ERYTECH社で最初に開発されたのは、がん代謝を標的にした製品で、赤血球内に封入された酵素L-アスパラギナーゼからなるエリスパーゼです。 L-アスパラギナーゼは、天然に存在するアミノ酸であるアスパラギンをアスパラギン酸とアンモニアに分解します。すべての細胞は、成長とタンパク質の合成のためにアスパラギンを必要とします。正常な細胞は、独自の合成を通じてアスパラギンのニーズの大部分を満たすことができますが、がん細胞は正常細胞よりもさらに成長して増殖するためにアスパラギンを必要としますが、十分なアスパラギンを独自に生成することができません。がん細胞は生き残るために循環しているアスパラギンに頼らなければなりません。この L-アスパラギナーゼは循環しているアスパラギンを分解することで取り除き、がん細胞から主要な栄養素を奪い、死に至らせます。 L-アスパラギナーゼの使用は、小児急性リンパ芽球性白血病(ALL)治療において確立された治療法ですが、毒性により、この患者集団を超えてその使用は制限されています。ERYTECH社は、エリスパーゼを開発したことで、膵臓がんやトリプルネガティブ乳がんなどの特定の固形腫瘍に対して、L-アスパルギナーゼの適応範囲を拡大することを目指しています。エリスパーゼ
■エリスパーゼの治験
エリスパーゼの治験では、患者は無作為にエリスパーゼ+ゲムシタビン/ナブパクリタキセル、またはエリスパーゼ+イリノテカンベースのレジメンのテストアーム、または標準化学療法単独のコントロールアームに登録されます。主要評価項目は全生存期間(OS)、無憎悪生存期間(PFS)です。暫定的な有効性評価は、イベントの3分の2が発生したときに計画されています。
◆テストアーム:
エリスパーゼ+ゲムシタビン/ナブパクリタキセル
または
エリスパーゼ+イリノテカンベースのレジメン
◆コントロールアーム
ゲムシタビン/ナブパクリタキセル
または
イリノテカンベースのレジメン
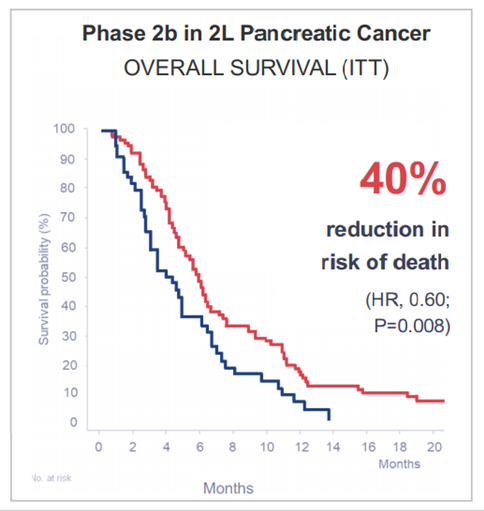
エリスパーゼのIIb試験では、全生存期間でハザード比0.60、無増悪生存期間で0.59のハザード比を有意に示しました。全体を通して、エリスパーゼは十分に許容され、標準的な化学療法に匹敵する安全プロファイルを示しました。
■ERYTECH社
2019年5月、フランスのバイオ医薬品会社Erytech Pharmaの最高医療責任者であるIman El Hariry氏は、次のように述べています。「特にファーストライン化学療法が進行した転移性膵臓がん患者には、治療の選択肢が十分ではありません。FDAがエリスパーゼの治験を承認したことで、米国ではTRYbeCA1治験が開始され、患者を登録できることを嬉しく思います。」
ヨーロッパでは米国に先駆けて2019年9月にスペインで患者登録が始まり、それから他の国でもTRYbeCA1治験が開始されています。
アメリカWeill Cornell Medicine、NewYork-Presbyterian's cancer programsの責任者であるマヌエル・イダルゴ(Manuel Hidalgo)博士は、「FDAがINDをレビューし、TRYbeCA1試験がアメリカで開始されことは、この致命的な病気と闘うアメリカの膵臓がん患者には朗報です。」と述べています。
Erytech社のErycapsプラットフォームは、新しい技術を使用して原薬を赤血球内にカプセル化し、重篤な形態の癌や孤児病に対する革新的な赤血球ベースの治療法を開発に使用されています。Erytech社はフランスのリヨンにある工場と米国のフィラデルフィアにあるアメリカ赤十字で医薬品を製造しています。同社は最近、米国ニュージャージー州のプリンストンに製造施設を建設しました。
ーーーーーーーーーーーーー
Source:
・ASCO Post 2020-05-01
・Erytech Press Release 2020-04-28
https://investors.erytech.com/news-releases/news-release-details/erytech-granted-us-fda-fast-track-designation-eryaspase-second