新しい薬物が細胞のDNA修復応答を標的とすることで、標的放射線療法の有効性を高めることはできるか?
海外ニュース:新しい薬物が細胞のDNA修復応答を標的とすることで、標的放射線療法の有効性を高めることはできるか?
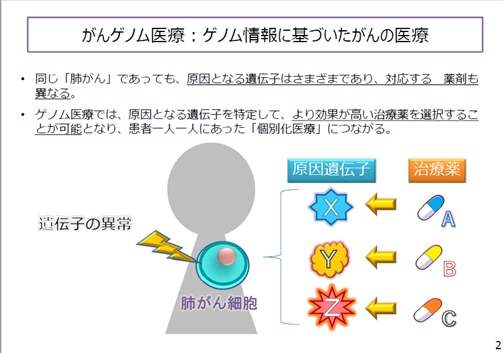
がんを治療するために医師が使用する戦略の一つは、DNA損傷を引き起こすことです。例えば、放射線療法を通じてDNA損傷を引き起こします。新しい薬物ペポセルチブは、DNA修復応答に関与する一部の酵素をブロックします。研究者は、この薬物を高用量の放射線療法と組み合わせることが、手術で摘出できない膵臓がんで、他の部位に広がっていない(局在した)患者に対して、単独の放射線療法よりも効果的であるかどうかを検証しています。
ペポセルチブとは何か?
放射線療法は二本鎖切断(DSBs)と呼ばれるDNA損傷を引き起こし、修復されないままであれば細胞や生物に致命的な影響を与えます。DNA修復をブロックする薬物を追加することで、DNAを損傷させる薬剤の感受性を高め、がん細胞の死亡を早めるのに役立つかもしれません。DNA依存性タンパク質キナーゼ(DNA-PK)は、DNA二本鎖切断の修復に重要な役割を果たします。ペポセルチブ(M3814)はDNA-PKを阻害する新しい薬物です。