国内ニュース:臓器横断型新薬の第三弾 エヌトレクチニブの販売開始
国内ニュース:臓器横断型新薬の第三弾 エヌトレクチニブの販売開始
~NTRK融合遺伝子陽性の膵臓がん、胆管がん、神経内分泌腫瘍、肉腫などの固形がんを対象~
2019年9月4日
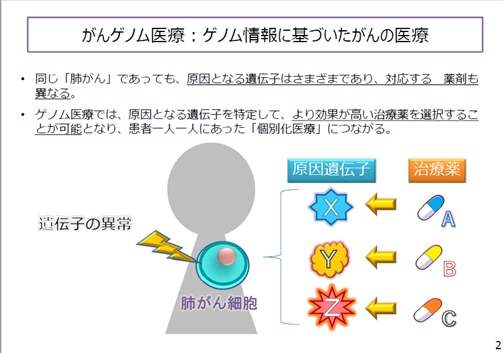
2018年12月18日に承認申請され、厚生労働省より先駆け審査指定制度の対象品目に指定され、本年6月18日、世界で初めての薬事承認を日本で取得したエヌトレクチニブ(商品名:ロズリートレクカプセル、中外製薬)は本日薬価収載され、即日発売開始されました。エヌトレクチニブはNTRK融合遺伝子陽性の固形がんに対する国内で初めての治療薬となります。この薬剤は、難治性がん(膵臓がん、胆菅がん、非小細胞肺がん等)、希少がん(神経内分泌腫瘍、肉腫、GIST等)を含む成人だけでなく、小児がんにも使用できることが特徴です。
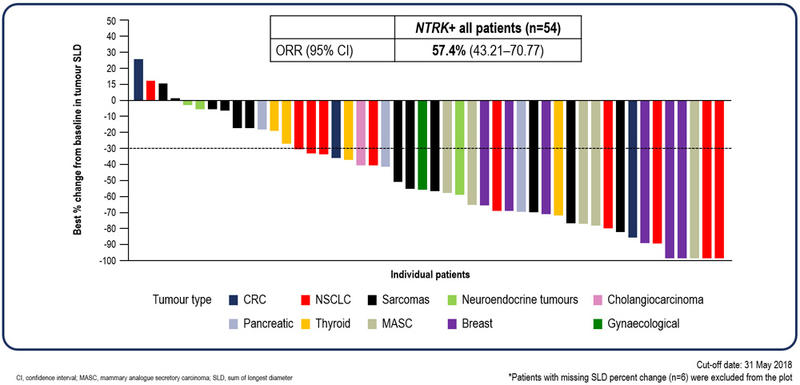
図:エヌレクチニブを使用したがん患者のがんの縮小率を示したWaterFall Plot。右端の5人の患者のがんは100%縮小したことを示している。左端の3人の患者のがんは15%~25%程度増大したことを示している。